Графит, молекуларна формула: C, молекуларна тежина: 12,01, е форма на елемент јаглерод, секој јаглероден атом е поврзан со три други јаглеродни атоми (поредени во саќе шестоаголници) за да се формира ковалентна молекула.Бидејќи секој јаглероден атом емитира електрон, оние кои можат слободно да се движат, така што графитот е проводник.
Графитот е еден од најмеките минерали, а неговата употреба вклучува изработка на кабли за моливи и лубриканти.Јаглеродот е неметален елемент сместен во вториот циклус IVA група на периодниот систем.Графитот се формира на високи температури.
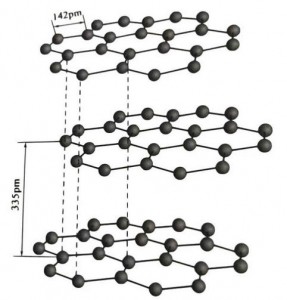
Графитот е кристален минерал од јаглеродни елементи, а неговата кристална решетка е хексагонална слоевита структура.Растојанието помеѓу секој мрежен слој е 3,35 А, а растојанието на јаглеродните атоми во истиот мрежен слој е 1,42 А.Тоа е хексагонален кристален систем со целосно слоевито расцепување.Површината на расцепување е главно молекуларни врски, помалку привлечни за молекулите, така што нејзината природна плови е многу добра.
Во графитните кристали, јаглеродните атоми во истиот слој формираат ковалентна врска со sp2 хибридизација, а секој јаглероден атом е поврзан со три други атоми во три ковалентни врски.Шестте јаглеродни атоми формираат шест-континуиран прстен во истата рамнина, кој се протега во структура на ламела, каде што должината на врската на CC врската е 142pm, што е точно во опсегот на должината на врската на атомскиот кристал, така што за истиот слој , тоа е атомски кристал.Атомите на јаглеродот во иста рамнина имаат една орбита p, кои се преклопуваат едни со други.Електроните се релативно слободни, еквивалентни на слободните електрони во металите, така што графитот може да спроведува топлина и електрична енергија, што е карактеристика на металните кристали.Така, исто така, класифицирани како метални кристали.
Средниот слој на графитниот кристал е одделен со 335 часот, а растојанието е големо.Тој е комбиниран со ван дер Валсовата сила, односно слојот припаѓа на молекуларниот кристал.Меѓутоа, бидејќи врзувањето на јаглеродните атоми во истиот рамнински слој е многу силно и исклучително тешко да се уништи, точката на растворање на графитот е исто така многу висока и неговите хемиски својства се стабилни.
Со оглед на неговиот посебен режим на поврзување, не може да се смета како еден кристал или поликристал, графитот сега генерално се смета за мешан кристал.
Време на објавување: 31 јули 2023 година